Електроліти - це речовини, розчини або розплави які проводять електричний струм. До електроліту відносяться кислоти, основи і солі. Речовини, що не проводять електричного струму в розчиненому або розплавленому стані, називають неелектролітами. До них відносяться багато органічних речовин, наприклад цукру, спирти та ін Здатність розчинів електролітів проводити електричний струм пояснюють тим, що молекули електролітів при розчиненні розпадаються на електрично позитивно і негативно заряджені частинки - іони. Величина заряду іона чисельно дорівнює валентності атома або групи атомів, що утворюють іон. Іони відрізняються від атомів і молекул не тільки наявністю електричних зарядів, але і іншими властивостями, наприклад іони хлору не мають ні запаху, ні кольору, ні інших властивостей молекул хлору. Позитивно заряджені іони називають катіонами, негативно заряджені-аніонами. Катіони утворюють атоми водню Н +, металів: К +, Na +, Са2 +, Fe3 + і деякі групи атомів, наприклад група амонію NH +4; аніони утворюють атоми і групи атомів, які є кислотними залишками, наприклад Cl-, NO-3, SO2- 4, CO2-3. Розпад молекул електролітів на іони називається електролітичної дисоціацією, або іонізацією, і являє собою оборотний процес, тобто в розчині може наступати стан рівноваги, при якому скільки молекул електролітів розпадається на іони, стільки їх знову утворюється з іонів. Дисоціація електролітів на іони може бути представлена загальним рівнянням: 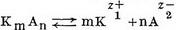 , де KmAn - недисоційованих молекул, Кz +1 - катіон, несучий z1 позитивних зарядів, Аz-2 - аніон, що має z2 негативних зарядів, m і n - число катіонів та аніонів, що утворюються при дисоціації однієї молекули електроліту. Наприклад, 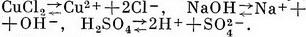 Число позитивних і негативних іонів у розчині може бути різним, але сумарний заряд катіонів завжди дорівнює сумарному заряду аніонів, тому розчин в цілому електронейтрален. Сильні електроліти практично повністю дисоціюють на іони при будь-яких концентраціях їх у розчині. До них відносяться сильні кислота, сильні підстави і майже всі солі. Слабкі електроліти, до яких відносяться слабкі кислоти і підстави і деякі солі, наприклад сулема HgCl2, дисоціюють лише частково; ступінь їх дисоціації, тобто частка молекул, що розпалися на іони, зростає зі зменшенням концентрації розчину. Мірою здатності електролітів розпадатися на іони в розчинах може служити константа електролітичної дисоціації (константа іонізації), рівна. 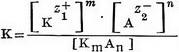 де в квадратних дужках показані концентрації відповідних частинок в розчині. При пропущенні через розчин електроліту постійного електричного струму катіони переміщаються до негативно зарядженого електроду - катода, аніони пересуваються до позитивного електрода - анода, де віддають свої заряди, перетворюючись на електронейтральні атоми або молекули (катіони отримують електрони від катода, а аніони віддають електрони на аноді) . Так як процес приєднання електронів до речовини є відновленням, а процес віддачі електронів речовиною - окисленням, то при пропущенні електричного струму через розчин електроліту на катоді відбувається відновлення катіонів, а на аноді-окислення аніонів. Цей окислювально-відновний процес називають електролізом. Електроліти є неодмінною складовою частиною рідин і щільних тканин організмів. У фізіологічних і біохімічних процесах велику роль грають такі неорганічні іони, як Н +, Na +, К +, Са2 +, Mg2 +, ОН-, С1-, НСО-3, H2РО-4, SO2-4. Іони Н + і ОН-в організмі людини знаходяться в дуже малих концентраціях, але їх роль в життєвих процесах величезна. Концентрація іонів Na + і Cl-значно перевершує таку усіх інших неорганічних іонів разом узятих.
Електроліти - речовини, розчини або розплави яких проводять електричний струм. Типовими електролітами є солі, кислоти та основи. Згідно теорії електролітичної дисоціації Арреніуса молекули електролітів в розчинах мимовільно розпадаються на позитивно і негативно заряджені частинки - іони. Позитивно заряджені іони називають катіонами, негативно заряджені - аніонами. Величина заряду іона визначається валентністю атома або групи атомів, що утворюють даний іон. Катіони утворюють зазвичай атоми металів, наприклад К +, Na +, Са2 +, Mg3 +, Fe3 +, і деякі групи інших атомів (наприклад, група амонію NH4); аніони, як правило, утворюються атомами і групами атомів, що є кислотним залишками, наприклад Cl-, J-, Br-, S2-, NO3-, CO3, SO4, PO4. Кожна молекула електронейтральна, тому число елементарних позитивних зарядів катіонів дорівнює числу елементарних негативних зарядів аніонів, що утворюються при дисоціації молекули. Наявністю іонів пояснюється здатність розчинів електролітів проводити електричний струм. Тому розчини електролітів називають іонними провідниками, або провідниками другого роду. Дисоціація молекул електролітів на іони може бути представлена наступним загальним рівнянням: де KpAq - недисоційованих молекул, Кn +1 - катіон, несучий n1 позитивних зарядів, Аn2 - аніон, що має n2 негативних зарядів, р і q - число катіонів та аніонів, що входять до складу молекули електроліту. Так, наприклад, дисоціація сірчаної кислоти і гідрату окису амонію виражається рівняннями: Кількість іонів, що містяться в розчині, прийнято вимірювати в грам-іонах на 1 л розчину. Грам-іон - маса іонів даного виду, виражена в грамах і чисельно рівна формульним вазі іона. Формульний вага знаходять підсумовуванням атомних ваг атомів, що утворюють даний іон. Так, наприклад, формульний вага іонів SO4-дорівнює: 32,06 +4-16,00 = 96,06. Електроліти поділяють на низькомолекулярні, високомолекулярні (поліелектроліти) і колоїдні. Прикладами низькомолекулярних електролітів, або просто електролітів, можуть служити звичайні низькомолекулярні кислоти, підстави і солі, які в свою чергу прийнято поділяти на слабкі і сильні електроліти. Слабкі електроліти не повністю дисоціюють на іони, внаслідок чого в розчині встановлюється динамічна рівновага між іонами і недіссоціірованнимі молекулами електролітів (рівняння 1). До числа слабких електролітів відносяться слабкі кислоти, слабкі підстави і деякі солі, наприклад сулема HgCl2. Кількісно процес дисоціації може бути охарактеризований ступенем електролітичної дисоціації (ступенем іонізації) α, ізотонічним коефіцієнтом i і константою електролітичної дисоціації (константою іонізації) К. Ступенем електролітичної дисоціації α називають ту частку молекул електролітів, яка розпадається на іони в даному розчині. Величина а, вимірювана в частках одиниці або в%, залежить від природи електроліту і розчинника: вона зменшується зі збільшенням концентрації розчину і зазвичай злегка змінюється (зростає або зменшується) зі збільшенням температури; вона також зменшується при введенні в розчин даного електроліту більш сильного електроліту, створюючого однойменні нони (наприклад, ступінь електролітичної дисоціації оцтової кислоти СН3СООН зменшується при додаванні до її розчину соляної кислоти HCl або ацетату натрію CH3COONa). Ізотонічний коефіцієнт, або коефіцієнт Вант-Гоффа, i дорівнює відношенню суми числа іонів і непродіссоцііровавшіх молекул електроліту до числа його молекул, взятих для приготування розчину. Експериментально i визначається шляхом вимірювання осмотичного тиску, зниження температури замерзання розчину і деяких інших фізичних властивостей розчинів. Величини i і α взаємопов'язані рівнянням де n - число іонів, що утворюються при дисоціації однієї молекули даного електроліту. |

